Considerazioni sull’elettroforesi proteica
Elettroforesi in fase libera
“Si definisce elettroforesi la migrazione di particelle cariche, attraverso un elettrolita sottoposto ad un campo elettrico. Se avranno cariche contrarie si muoveranno in direzioni opposte, quelle positive verso il catodo e quelle negative verso l’anodo. La velocità di migrazione delle particelle di carica dello stesso segno dipenderà, dal numero di cariche che ciascuna porta, (in realtà anche dal peso e dall’ingombro sterico)”, recitano i sacri testi.
E poi ancora: “In conseguenza delle diverse velocità di migrazione, un miscuglio complesso, come le proteine del plasma del siero, o altro liquido biologico, può essere separato in diverse frazioni in base alla mobilità, e la definizione di tale separazione dipenderà dal grado di omogeneità relativa alla mobilità di ciascuna frazione”.
La prima tecnica ampiamente usata fu quella di Tiselius (1937, 1939). Separò le proteine in un elettrolita liquido contenuto in un tubo ad “U” di quarzo, e determinò la posizione e le dimensioni delle diverse frazioni osservando le variazioni dell’indice di rifrazione alla frontiera tra le bande proteiche. Questo tipo di separazione in una soluzione omogenea è stata definita “elettroforesi a frontiera mobile” a “confine mobile”, “frontale” o “in fase libera”. Gli apparecchi per l’esecuzione di tale tecnica erano complessi e costosi ed è per questo che sono stati usati relativamente poco.
Elettroforesi zonale
Con l’elettroforesi, Frederick Sanger riuscì a determinare la sequenza proteica degli aminoacidi dell’insulina. Iniziò riducendo l’insulina in frammenti più piccoli, attraverso la digestione ottenuta con l’aggiunta di tripsina. Ne depositò quindi una piccola quantità su un foglio di carta da filtro ed utilizzò una tecnica mista elettroforesi-cromatografia. In base alla loro solubilità ed alla carica elettrica i diversi frammenti di insulina migrarono in differenti posizioni sulla carta, creando distinti pattern. Sanger chiamò questi pattern “fingerprints” “impronte digitali”, in quanto identificativi di ogni proteina. Riassemblando i frammenti nelle sequenze di aminoacidi, dedusse la struttura completa dell’insulina, concludendo che l’insulina ha una precisa sequenza di aminoacidi. Per questo, Nobel per la chimica nel 1958.
Fu proprio in seguito all’introduzione della carta da filtro, che la diffusione dell’elettroforesi divenne più consistente, anche se la vera e propria diffusione dell’elettroforesi, come tecnica di routine, si potuta registrare con l’avvento di tecniche più semplici e che maggiormente si prestano ad un utilizzo massivo.
Già con l’introduzione dell’elettroforesi su carta molti laboratori cominciarono ad adottarla negli anni 60 e 70; tuttavia la tecnica presentava alcune difficoltà pratiche, che ne limitarono l’utilizzo:
La separazione richiedeva alti voltaggio (dell’ordine di 10000 Volt).
Per ottenere risultati apprezzabili erano necessari tempi molto lunghi (tipicamente tutta la notte). Le bande ottenute (albumina, alfa, beta e gamma) apparivano sfumate e la risoluzione non era tale da garantire accuratezza e ripetibilità dei risultati. Per la quantificazione delle bande era preferibile eluirle sciogliendole in acido acetico, poi leggere le assorbanze allo spettrofotometro ed infine calcolarne manualmente le percentuali e le concentrazioni, o in alternativa leggere direttamente su densitometri commerciali.
La differenza fondamentale, dal punto di vista pratico, tra elettroforesi in fase libera ed elettroforesi su supporto, era che mentre nel primo caso i confini delle zone di separazione erano “effimeri” in quanto soggetti a moti convettivi, nel secondo caso c’era la possibilità di fissare le proteine, facendole precipitare all’interno delle “maglie” del supporto stesso, utilizzando denaturanti come l’acido tricloroacetico (TCA) o semplicemente il calore. Successivamente alla denaturazione, era possibile colorare le proteine con dei coloranti specifici, per poi, attraverso l’uso di decoloranti, rimuovere l’eccesso di colorante, lasciando intatto solo quello effettivamente legato alle proteine, rivelandone, così, la presenza e la ripartizione in bande distinte.
Numerosi altri supporti che erano stati sperimentati, vennero utilizzati dalle aziende per verificarne la possibilità di produzione su scala industriale, o quanto meno artigianale, nel corso degli anni: gel di silice, gel di agar, gel di amido, gel di agarosio, gel di poliacrilammide, acetato di cellulosa, ecc. Per vari motivi, però, non tutti i supporti si dimostrarono adatti all’utilizzo routinario. Alcune aziende iniziarono a verificare la possibilità di produrre supporti che permettessero separazioni proteiche secondo tecniche semplici e facilmente riproducibili.
Apparve subito chiaro che i supporti più adatti erano l’acetato di cellulosa e il gel di agarosio. I due supporti, infatti, ben si prestavano ad una produzione in serie, e, una volta confezionati si mantenevano facilmente per lunghi periodi. Per quanto riguarda la facilità d’uso, tuttavia, l’acetato di cellulosa era di gran lunga più maneggevole, mentre il gel di agar e l’agarosio presentavano dei punti critici per il fatto che il gel poteva essere danneggiato anche solo toccandolo con le dita, inoltre presentava, inizialmente, tempi più lunghi di trattamento, oltre ad alcuni passaggi critici. Il costo dell’agarosio, inoltre era più elevato, e anche se la qualità del risultato finale poteva risultare migliore in termini di risoluzione e definizione delle bande, questo poteva essere ottenuto soltanto eseguendo la tecnica a regola d’arte in tutti i suoi numerosi passaggi manuali. Questo spiega il grande successo dell’acetato di cellulosa che invece permetteva:
Separazioni a voltaggi relativamente bassi (intorno ai 200 V)
Basso amperaggio (5-15 mA /striscia)
Tempi brevi di separazioni (inizialmente 30-45’ oggi 10-15’).
Le bande ottenute apparivano abbastanza nette, e la risoluzione era tale da garantire passi avanti in termini di ripetibilità ed accuratezza dell’analisi.
La quantificazione dei risultati era affidata, nella maggioranza dei casi, a densitometri commerciali e l’indaginosa pratica dell’eluizione venne quasi del tutto abbandonata.
Le pellicole di acetato di cellulosa potevano essere prodotte con un buon livello di standardizzazione allo spessore di circa 0,2 mm e con una porosità di circa 40-45 micron.
Le aziende italiane si orientarono inizialmente per la produzione di membrane conservate in umido, in una soluzione di alcool metilico (Cellogel della Chemetron del Dr. Del Campo, dagli anni ‘60, Poliphor della Elvi, Pherostrips ecc.), mentre quelle tedesche (Sartorius, Schleicher & Schuell), americane (Gelman, Helena) e giapponesi (Fuji) misero a punto dei metodi di stratificazione che permettevano la conservazione a secco delle membrane. Già alla fine degli anni settanta, inoltre, le due principali aziende americane iniziarono a stratificare l’acetato anche su supporti di Mylar, ed una delle due (Gelman) sperimentò anche la stratificazione su Mylar del nitrato di cellulosa, come alternativa all’acetato. Seguirono anche le due aziende tedesche, con risultati inferiori alle aspettative, dal punto di vista commerciale, e qualche problema tecnico di troppo. Bisogna attendere la seconda metà degli anni 80 per trovare anche aziende italiane impegnate nella produzione dell’acetato secco di cellulosa (prima la Sclavo, e poi la Me.Dia.) sia supportate in Mylar che non. Le aziende italiane, comunque sono state sempre presenti, e in alcuni casi all’avanguardia nel settore dell’elettroforesi.
Camere Umide, Depositori, Alimentatori, Tamponi e altri reagenti
Parallelamente allo sviluppo della produzione di acetato di cellulosa, furono messe a punto diverse tipologie di camere di migrazione.
Il nome stesso utilizzato, “Camera Umida”, rende bene l’idea di quale doveva essere la principale preoccupazione dei costruttori: il supporto in acetato di cellulosa (ma anche l’Agarosio), una volta imbibito nel tampone, e parzialmente asciugato per eliminarne l’eccesso, dal momento stesso in cui viene sottoposto a passaggio di corrente elettrica, inizia a perdere liquido, sia per evaporazione diretta dovuta all’effetto Joule, sia per elettrolisi nei punti di contatto con il tampone. Questo fenomeno può causare un continuo richiamo di liquido dall’ambiente circostante, che se non è sufficientemente saturo di umidità, non è in grado di compensarne la perdita, provocando incontrollabili artefatti, dovuti alla formazione di gradienti irregolari di umidità e conseguentemente anche della resistenza elettrica del supporto, oltre ad un richiamo di liquido direttamente dal tampone in flussi dal fronte irregolare. Altri inconvenienti potevano verificarsi a causa dello spessore e del tipo di elettrodi utilizzati, del tipo di tampone, ecc. ecc.
I principali punti critici individuati, possono essere riassunti nella seguente tabella:

Qualità della deposizione:
numerosi fattori incidono sulla qualità della deposizione del campione, e nel tempo sono state adottate molte soluzioni costruttive per ottimizzare il contatto tra depositore e supporto elettroforetico:
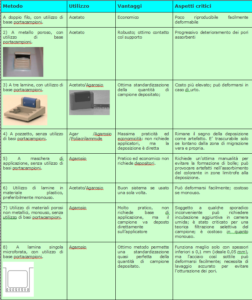
Come specificato nella tabella, per l’utilizzo degli applicatori, nella maggior parte dei casi, sono necessarie delle basi su cui viene depositato il campione, successivamente prelevato dall’applicatore. I costruttori hanno, nel tempo immesso sul mercati diversi tipi di basi, che possono essere raggruppate nelle seguenti categorie:

Gli Alimentatori:
I primi alimentatori per elettroforesi zonale, vennero costruiti per l’elettroforesi su carta. Per ottenere delle separazioni accettabili era necessario applicare una differenza di potenziale di circa 10000 Volt per parecchie ore. Non c’erano particolari difficoltà costruttive, e gli alimentatori utilizzavano tecnologie simili a quelle usate per alimentare i tubi catodici. A quell’epoca eravamo ben lontani dall’applicare rigide norme antinfortunistiche, ed anche la ben nota legge “626”, ormai superata, era lontana dall’essere anche solo concepita, tuttavia anche allora si guardava con una certa apprensione all’idea di aver a che fare con apparecchiature che applicavano ai capi di un foglio di carta, immerso in un liquido dotato di una certa conducibilità, tensioni così elevate. La ElVi, ed altre aziende ne vendettero moltissime, con buona soddisfazione da parte della clientela, e non si hanno notizie di incidenti, tuttavia quando presero piede gli alimentatori per elettroforesi su acetato di cellulosa a voltaggi molto più bassi, fu un sollievo per tutti e specie per i tecnici che dovevano maneggiarli.
Alla fine degli anni ’70 la Biotecnica, la ElVi, la Chemetron, la Ciampolini, la CGA, la Minivolt, oltre alla Gelman la Helena la Beckman e tante altre aziende producevano alimentatori a voltaggio costante con voltaggi impostabili tra 0 e 500 Volt adatti alle separazioni elettroforetiche su acetato di cellulosa o agarosio.
Le caratteristiche tecniche che doveva avere un alimentatore per essere compatibile con l’elettroforesi erano – e sono ancora – le seguenti:
Voltaggio di almeno 200 – 300 Volt.
Capacità di erogare correnti massime dell’ordine di 20 – 50 mA per l’acetato e 100 – 150 mA per l’agarosio.
Caduta di tensione minima possibile, in relazione al carico applicato.
Protezione dai corti circuiti e dai sovraccarichi.
Non sembrano molto importanti, invece, caratteristiche come ripple (residuo di oscillazione) particolarmente bassi, a patto che le oscillazioni non contengano residui di corrente alternata. In abbinamento con le camere a strisce multiple invece è fondamentale, per una buona ripetibilità dei risultati, che non si verifichino cadute di tensione progressivamente più consistenti con l’aumentare del carico: in questo caso, infatti, succede che una volta impostato voltaggio di lavoro, questo si mantiene più vicino al valore nominale con una sola striscia, e subisce invece una maggior caduta con un numero di strisce maggiore, con la conseguenza che si rischia di ottenere, a parità di tempo, una lunghezza della migrazione dipendente in modo inverso, dal numero di strisce messe a migrare contemporaneamente.
Una variante particolarmente interessante è l’utilizzo di alimentatori a corrente costante in cui è possibile impostare un valore di corrente per ottenere l’adattamento automatico del voltaggio, in funzione del carico applicato:
la differenza fondamentale è che, dato che il supporto elettroforetico diminuisce nel tempo, durante la migrazione, la propria resistenza elettrica, in un’elettroforesi a voltaggio costante si ottiene un aumento del passaggio di corrente durante la migrazione, e conseguentemente il riscaldamento dovuto all’effetto Joule tende ad aumentare nel tempo, con il rischio di un aumento progressivo della diffusione con perdita di definizione delle bande; nell’elettroforesi a corrente costante, invece, quest’effetto viene compensato dal fatto che per mantenere costante la corrente, il voltaggio deve diminuire nel tempo, e conseguentemente diminuisce anche il riscaldamento dovuto all’effetto joule.
Gli alimentatori a voltaggio costante sono ottimi per tempi brevi di migrazione o supporti che non tendano a riscaldare troppo, mentre gli alimentatori a corrente costante sono più adatti nei casi in cui è importante evitare il rischio che il prolungarsi della migrazione possa compromettere la nettezza delle bande o il mantenimento dell’umidità del supporto.
Un’altra categoria è quella degli alimentatori a potenza costante.
In teoria sono i migliori in assoluto, dato che lo spostamento delle proteine è in primo luogo direttamente proporzionale alla potenza, ed inoltre, anche lo sviluppo di calore, dovuto all’effetto Joule, può essere previsto con precisione tenendo sotto controllo la potenza alla quale avviene la migrazione. Unico neo: il prezzo proibitivo per la complessità dell’elettronica necessaria per arrivare alla potenza costante utilizzando esclusivamente hardware. Questo ne ha limitato la diffusione riservandone l’utilizzo solo per quelle applicazioni nelle quali si potevano notare effettivi vantaggi (soprattutto poliacrilammide ed altre applicazioni non routinarie). Negli anni ’90 tuttavia iniziarono a prendere piede soprattutto all’interno di apparecchiature semiautomatiche per agarosio a doppio fronte di migrazione, nelle quali è fondamentale gestire con estrema precisione la lunghezza di migrazione (p.es. hydrasys) per evitare che i due fronti di migrazione potessero confondersi. Non è stato ancora utilizzato il metodo della potenza costante su acetato di cellulosa, anche se di recente sono stati effettuati esperimenti incoraggianti su sistemi automatici in fase di sviluppo. La possibilità di ottenere alimentatori a potenza costante, o a corrente costante, a partire da un semplicissimo ed economico alimentatore classico a tensione costante è ormai una realtà nei sistemi automatici di nuova generazione, attraverso la gestione computerizzata: un software interroga migliaia di volte al secondo l’alimentatore, e confronta la grandezza richiesta con quella desiderata (ad esempio la potenza di 10 W); se il valore rilevato risulta inferiore a quello richiesto, incrementa il voltaggio, altrimenti lo diminuisce, fino a raggiungere il valore richiesto, dopo di che lo lascia inalterato fino a quando una variazione nelle condizioni elettriche non ne richiede un nuovo aggiustamento. Il vantaggio di un metodo simile è evidente, ed inoltre permette di programmare anche condizioni operative complesse, ma si presta meglio all’utilizzo integrato ad un sistema automatico dove è già previsto l’uso di un Pc.
La maggior parte delle aziende ha ritenuto fondamentale presentarsi sul mercato, innanzi tutto, con un tampone idoneo alla separazione delle proteine del siero, per ovvi motivi commerciali. Fu subito chiaro che il miglior tampone era il Veronal (Acido barbiturico e barbiturato di sodio), ma quando, negli anni ’80 ne venne regolamentata la commercializzazione, in quanto inserito nella tabella delle sostanze psicotrope, iniziò una corsa alla ricerca di alternative altrettanto valide; vennero di nuovo riesaminati numerosi tamponi già sperimentati in passato, ne furono sperimentati di nuovi, e soprattutto si utilizzarono “sistemi tampone” con miscele di differenti tamponi che permettevano di differenziare leggermente le varie offerte commerciali.
Mentre a metà degli anni ’80 si affermavano le “Raccomandazioni provvisorie SiBioC” di F.Aguzzi, D.Fenili e di tutto il gruppo della “commissione proteine”, che codificavano le caratteristiche qualitative minime per l’elettroforesi delle sieroproteine, le aziende si scontravano con alcune contraddizioni del mercato che imponevano una diversificazione nell’offerta dei tamponi con differenti capacità risolutive: da un lato si richiedeva la capacità di raggiungere elevate performances qualitative con eccellenti caratteristiche di risoluzione in 12 o più bande relative ad altrettante proteine specifiche, ma dall’altro nella routine quotidiana si richiedevano tamponi che evitassero assolutamente anche la semplice separazione delle beta o l’identificazione della pre-albumina, giustificando, in alcuni casi, questo atteggiamento antiscientifico con la presunta difficoltà di interpretazione dei risultati da parte dei medici di base.
La necessità di conseguire la padronanza di alcuni effetti sulla separazione proteica dipendenti da specifiche caratteristiche dei tamponi, emerse chiaramente per l’importanza tecnica e quindi commerciale, e dopo vari tentativi, la maggior parte delle aziende fu in grado di gestire alcune proprietà dei tamponi:
- – La possibilità di favorire lo sdoppiamento della frazione “beta” – come vivamente consigliato dalla comm.05 SiBioC – aggiungendo al tampone sostanze in grado di liberare ioni calcio (Ca++) – generalmente lattato di calcio.
- – La possibilità di evitare lo sdoppiamento della frazione Beta – nonostante le raccomandazioni della comm.05 SiBioC, per le suddette (e presunte) difficoltà nelle “relazioni culturali” con i medici di base – attraverso l’aggiunta di un chelante come l’EDTA che sottrae il calcio ostacolandone la disponibilità.
- – Rigido controllo della conduttività come fattore di primaria importanza per la gestione della lunghezza della migrazione, e fondamentale per il controllo dell’effetto Joule e dell’evaporazione del sistema.
- – La possibilità di agire sulla “leva” della forza ionica per bilanciare il rapporto tra forza elettromotrice (campo elettrico) ed elettroendosmosi, per gestire la separazione della zona veloce della migrazione (Albumina-Alfa1) e la retromigrazione della zona lenta (gammaglobuline).
- – La possibilità di agire direttamente sull’elettroendosmosi modificando la posizione dell’intero tracciato elettroforetico attraverso l’uso di miscele di tamponi, che includendo tra i vari componenti anche piccole quote di acidi triprotici, (come l’acido citrico) permettono di aumentare la forza ionica, senza aumentare troppo la conduttività. In questo modo l’intero blocco di migrazione si può spostare in avanti.
Una volta terminata la fase di migrazione, è necessario passare all’evidenziazione delle bande proteiche separate. La maggior parte dei metodi elettroforetici su supporto, (acetato, agarosio, ecc.) prevedono due passaggi fondamentali: la fissazione delle proteine al supporto, e la colorazione delle stesse. Le proteine, infatti, durante la migrazione possono spostarsi all’interno del supporto in quanto libere, in fase liquida, ma per poter essere colorate, in modo da permettere l’analisi dei tracciati ed eventualmente la loro conservazione, è necessario impedire che lo spostamento delle proteine possa continuare per diffusione, alterando la morfologia della migrazione stessa. Per ottenere questo risultato, è necessario denaturare le proteine per farle aderire stabilmente al supporto. I più diffusi metodi per ottenere la precipitazione delle proteine nelle “maglie” dei vari supporti sono:
- – Acido Tricloroacetico (dal 2% al 20%) – il metodo più usato
- – Acido Solfosalicilico (dal 10% al 30%) – buono, ma richiede tempi più lunghi; è consigliato per colorazioni su sistemi automatici che utilizzino tuberie siliconiche.
- – Acido acetico – inferiore al TCA
- – Alcool Metilico –
- – Acido picrico saturo in acido acetico al 17-20% – fissa anche le più piccole frazioni proteiche
- – Denaturazione al calore (65 °C circa) – adatto solo per l’Agarosio
- – Antisieri specifici – (solo per tecniche di immunofissazione o immunoelettroforesi)
Nel corso degli anni sono stati testati numerosi diversi coloranti, in grado di colorare le frazioni proteiche.
E’ chiaro, però che i produttori, per semplicità, economia e facilità d’uso, hanno, fin dall’inizio dato maggior spazio a quei coloranti che mostravano una buona solubilità in soluzioni adatte a fissare le proteine, in modo da permettere di evitare il doppio passaggio fissazione-colorazione, con evidente semplificazione della metodica.
Tra tutti il Rosso Ponceau S ed il Nero D’Amido, sono quelli che hanno raggiunto la maggior diffusione per le tecniche sieroproteiche su acetato di cellulosa ed agarosio.
Su Acetato (e nitrato) di cellulosa, il Nero D’Amido, di fatto, è stato praticamente abbandonato ormai da molti anni, in parte anche per le maggiori difficoltà nella decolorazione, nonostante la buona linearità di risposta alla lettura densitometrica.
Il Rosso Ponceau S, invece si è diffuso capillarmente, in associazione con l’acetato di cellulosa, soprattutto per la possibilità di essere perfettamente solubile in acido tricloroacetico (TCA), che ne consente l’uso, in piena sicurezza, senza necessità di preventiva fissazione delle proteine, ma anche perché tra tutti i coloranti, è quello che, su acetato, offre il miglior compromesso tra qualità, prezzo, e comodità d’uso.
Unica limitazione, del Rosso Ponceau S è, forse, la non eccezionale sensibilità che lo rende inadatto alle tecniche di multifrazionamento, ma d’altra parte, l’ottima linearità, ha facilitato, per i produttori,la costruzione di sistemi densitometrici non troppo elaborati. Unica alternativa, con le medesime caratteristiche, potrebbe essere il Blu Lisander, un po’ più sensibile, ma il costo più elevato, di fatto ne confina l’uso in associazione con tecniche particolari come l’immunofissazione.
Su Agarosio, invece, il Nero D’Amido è sempre stato il colorante d’elezione, per vari motivi: prima di tutto perché sull’agarosio è ininfluente il passaggio di fissazione preventiva, in quanto il gel va, in ogni caso, essiccato prima della colorazione, per ridurne lo spessore, allo scopo di evitare tempi esageratamente lunghi di colorazione e decolorazione; altro aspetto non trascurabile, è che il Nero D’Amido presenta una sensibilità maggiore del Rosso Ponceau S, e permette quindi di apprezzare anche piccole bande; infine bisogna considerare che il Rosso Ponceau S viene venduto generalmente in soluzione già comprendenti il fissativo, e l’agarosio, non tollera bene il contatto prolungato con TCA o acido solfosalicilico, e se si supera un certo tempo, si possono rischiare artefatti (aloni di opacità) indesiderati.
Ottima alternativa al Nero D’Amido, su Agarosio, è il Violetto Acido, ottimo per colorazioni automatizzate.
Il Blu di Coomassie rimane, per la sua sensibilità il colorante d’elezione in tutte le tecniche in cui sia necessario evidenziare anche le bande più tenui, ma i coloranti metallici, Silver Stain e Golden Stain, sono ormai riconosciuti universalmente, per la loro eccezionale sensibilità, come i migliori coloranti su liquidi biologici a basso contenuto proteico, come l’urina o il liquido cefalo rachidiano.
La Nigrosina non viene praticamente utilizzata, se non per la presentazione di diapositive, soprattutto per i tempi esageratamente lunghi di colorazione, anche se fornisce una colorazione molto limpida, mentre il Blu di Bromofenolo trova impiego specialmente come tracciante per l’Albumina per identificare il fronte di migrazione durante la corsa, data la sua capacità di legarsi al campione senza interferire con la sua mobilità elettroforetica.
In linea di principio, infine, va fatto presente, che i coloranti fin qui elencati, funzionano in modo molto simile, ed è possibile effettuare colorazioni successive, tenendo conto che il colorante più “leggero” (p.es. Rosso Ponceau S) può essere “spostato” e sostituito da uno più “forte” (p.es. Blue Coomassie) ed in casi particolari si può decidere inizialmente per tipo di colorazione per poi, se si desidera una maggior sensibilità, optare per una colorazione più intensa.
Tra i coloranti, vanno citati anche quelli specifici per Lipoproteine, ed i substrati per l’evidenziazione degli isoenzimi.
I coloranti per Lipoproteine utilizzano un principio completamente diverso: colorano la porzione lipidica dei complessi lipoproteici, ed in genere vengono usati in soluzioni estemporanee a perdere, nelle quali l’aggiunta di una soluzione alcalina favorisce la formazione di flocculati che permettono una colorazione netta delle sole bande lipoproteiche senza la formazione di apprezzabile colore di fondo. Sudan Black e Fat Red utilizzano questo metodo, con un’unica differenza: il Fat Red 7B è sciolto in metanolo, più lipofilo dell’etanolo, e questo permette di velocizzare oltre modo la fase di colorazione, impiegando 15’ invece di 30-45’ necessari con il Sudan Back disponibile, invece in alcool etilico.
Diverso è il caso dell’Oil Red che riesce a colorare – in tempi molto lunghi, su acetato di cellulosa, e con una colorazione intensa anche del fondo che poi va decolorato – anche senza l’utilizzo di soluzioni fortemente alcaline, evitando così la deacetilazione dell’acetato che quindi può essere trasparentizzato e conservato in modo classico. L’uso della soda, invece, provoca un cambiamento della struttura dell’acetato che ne impedisce la successiva trasparentizzazione, ed impone che l’eventuale conservazione avvenga in umido.
Per il favorevole rapporto qualità/prezzo, il più diffuso è sempre stato sicuramente il Sudan Nero.
Per quanto riguarda i metodi di rivelazione degli isoenzimi, si può dire che i substrati normalmente utilizzati in chimica clinica possono essere utilizzati per un’incubazione a sandwich (generalmente in camera umida a 37°C) che permetta l’evidenziazione delle diverse bande isoenzimatiche. Per rendere più comodo il metodo, spesso si utilizzano sali di tetrazolio che permettono colorazione direttamente visibile, senza bisogno di ricorrere alla fluorescenza.
Di seguito una tabella di comparazione dei coloranti più usati:

 4913total visits,2visits today
4913total visits,2visits today